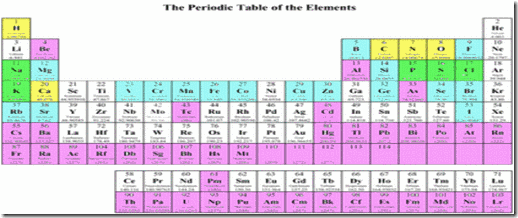
Pengenalan
Jadual berkala ialah pengkelasan unsur-unsur kepada kumpulan tertentu mengikut pertambahan atom dan konfigurasi electron. Bentuk lama jadual berkala telah dihasilkan oleh Mendeleef dalam tahun 1869. Dalam jadual berkala Mendeleef,unsur-unsur disusun dalam tertib jisim atom atau relatif. Dalam jadual berkala moden
a) Unsur-unsur disusun dalam tertib nombor atom bertambah/menaik.
b) Barisan mengufuk unsur dnamakan kala
c) Turus menegak unsur dinamakan kumpulan
Pengertian dan sifat kumpulan
· Kumpulan ialah turus menegak
· Terdapat 18 turus menegak dibahagikan kepada 8 kumpulan
a) Kumpulan 1 = logam alkali
b) Kumpulan 2 = logam alkali bumi
c) Kumpulan 3 hingga 12 = unsur-unsur peralihan
d) Kumpulan 17 = halogen
e) Kumpulan 18 = gas adi
· Kesemua unsur suatu kumpulan mempunyai bilangan electron valaens yang sama,maka unsur-unsur dalam kumpulan yang sama mempunyai sifat-sifat kimia yang sama manakala sifat fizik berbeza.
Perubahan sifat fizik
1. Saiz atom
2. Saiz ion
3. Tenaga pengionan
4. Keelektronegetifan
Ø Saiz atom
· Saiz atom atau jejari bertambah apabila menuruni kumpulan kerana nombor atom bertambah semasa menuruni kumpulan diikuti oleh pertambahan petala electron.
· Pertambahan petala electron menyebabkan electron di petala terluar lebih jauh dari nukleus dengan saiz atom bertambah.
· Saiz atom berkurang apabila merentasi kala kerana daya tarikan nukleus bertambah sementara bilangan petala electron tidak berubah.
· Apabila merentasi kala dari kiri ke kanan electron di tambah ke dalam petala valens.
· Bilangan proton bertambah menyebabkan cas nukleus berkesan bertambah
· Cas nukleus berkesan merupakan cas bersih yang dirasai oleh electron valens kerana tarikan oleh nukleus
· Oleh itu,tarikan nukleus terhadap electron valens bertambah menyebabkan jejari atom semakin berkurang apabila merentasi kala dari kiri ke kanan.
Ø Saiz ion
· Ion terbentuk apabila suatu atom menerima atau menderma satu atau lebih electron.
· Penerimaan dan pendermaan electron ini akan menyebabkan saiz ion berubah dari
· saiz atom asalnya.
· Saiz kation dan anion semakin bertambah kerana pertambahan petala dan wujud kesan penskrinan oleh electron di petala dalam yang mengurangkan tarikan nukleus ke atas electron petala valens
· Saiz kation dan anion semakin berkurang.
Ø Tenaga pengionan
· Tenaga pengionan ialah tenaga yang diperlukan untuk mengeluarkan electron dari atom neutral
· Bagi satu unsur X,persamaan yang terlibat adalah :
X (g) – X + (g) + e-
· Tenaga yang diperlukan untuk menyingkirkan electron yang pertama disebut
· tenaga pengionan pertama
· Tenaga pengionan dipengaruhi oleh faktor-faktor yang berikut :
I. Saiz atom
» -apabila saiz atom bertambah,tarikan nukleus terhadap electron valens
» berkurang menyebabkan tenaga pegnionan rendah.
II. Cas pada nukleus
» pertambahan cas nukleus berkesan menyebabkan tarikan nukleus terhadap
» electron valens semakin kuat,tenaga pengionan bertambah.
III. Kesan lindungan/Penskrinan dari petala-petala terdalam
» kesan penskrinan mengurangkan kesan tarikan nukleus ke atas electron
di petala valens menyebabkan pengurangan nilai tenaga pengionan
· Tenaga pengionan berkurang menuruni kumpulan kerana :
1. Pertambahan saiz atom/jejari atom bertambah
2. Tarikan nukleus terhadap electron valens semakin berkurang
· Tenaga pengionan semakin bertambah kerana :
1. Pertambahan cas nukleus bertambah dengan pertambahan bilangan atom manakala jejari atom berkurangan dari kiri ke kanan
Ø 4.Keelektronegetifan
- Keelektronegetifan ialah kemampuan relative suatu atom semakin tinggi kecenderungan untuk menarik electron kepadanya
· Berkurang
· Bertambah
KUMPULAN 1
Logam alkali merupakan siri kimia. Ia merupakan unsur-unsur logam dalam Kumpulan 1 Jadual berkala, iaitu: litium, natrium, kalium, rubidium, sesium dan fransium. Unsur-unsur ini amat reaktif dan jarang dijumpai dalam bentuk unsur.
Unsur-unsur ini biasanya berwarna keperakan, lembut, mempunyai ketumpatan rendah.
KUMPULAN 2
Logam alkali bumi ialah unsur dalam Kumpulan 2 Jadual berkala yang mempunyai 2 elekton valens. Bersifat logam. Unsur-unsur tersebut ialah Berilium, Magnesium, Kalsium, Strontium, Barium dan Radium.
KUMPULAN 3 HINGGA 12
Kumpulan unsur 3 juga dipanggil kumpulan skandium merupakan unsur kimia yang terkandung dalam lajur ke-3 jadual berkala unsur.
Memandangkan IUPAC tidak mencadangkan format spesifik untuk jadual berkala, oleh sebab itu, beberapa variasi bagi jadual berkala adalah dibenarkan dan selalu digunakan untuk kumpulan 3. Logam peralihan blok d di bawah sentiasa dianggap sebagai ahli kumpulan 3:
v skandium (Sc), unsur yang lebih banyak ditemui di matahari dan sesetengah bintang berbanding bumi, sangat lembut dan sangat cepat bertindak balas dengan kebanyakan asid.
v ytrium (Y), unsur yang banyak terkandung dalam batu-batuan bulan dan digunakan untuk menghasilkan warna merah pada kaca televisyen.
Apabila merumuskan unsur kumpulan 3 yang lain, 4 variasi yang berlainan boleh wujud:
v Sesetengah jadual memasukkan lantanum (La) dan aktinium (Ac), (unsur pertama dalam siri lantanida dan aktinida masing-masing) sebagai unsur kumpulan 3 yang selebihnya. Dalam bentuk ion tripositif yang biasa ditemui bagi kedua-dua unsur tersebut, unsur ini tidak mengandungi sebarang orbital f yang terisi, dengan itu menyebabkannya mempunyai sifat lebih menyerupai blok d.
v Sesetengah jadual memasukkan lutetium (Lu) dan lawrensium (Lr) sebagai ahli kumpulan 3 yang selebihnya. Unsur-unsur ini adalah unsur yang paling akhir dalam siri lantanida dan aktinida masing-masing. Memandangkan petala-f secara nominalnya penuh bagi konfigurasi elektron pada keadaan asas(ground state) untuk kedua-dua logam ini, ia menunjukkan ciri-ciri hampir seperti logam blok d , yang mana mempamerkan persamaan dengan sifat bagi Sc dan Y. Untuk Lr, ciri-ciri ini hanyalah dijangkakan sahaja, tetapi ia belum pernah dikaji sepenuhnya kerana tidak terdapat kuantiti yang mencukupi.
Sesetengah jadual pula merujuk kepada semua ahli dalam lantanida dan aktinida sebagai tanda dalam kumpulan 3. Berikut adalah alternatif ke-3 dan ke-4 yang dicadangkan:
v Alternatif ke-3 merujuk kepada kesemua 30 unsur lantanida dan aktinid sebagai ahli Kumpulan 3. Lantanida, sebagai logam trivalen elektropositif, kesemuanya memiliki hubungan kimia yang hampir sama, dan kesemuanya menunjukkan banyak persamaan dengan Sc dan Y.
v Variasi keempat pula tidak memasukkan mana-mana ahli lantanida dan aktinida dalam Kumpulan 3. Ahli-ahli lantanida memiliki sifat atau ciri-ciri tambahan bagi sebahagian orbital f-nya yang terisi yang mana adalah tidak sama dengan Sc dan Y. Selain itu, aktinida menonjolkan lebih banyak ketaksamaan kimia (seperti lingkungan tahap pengoksidaan) jika dibandingkan dengan siri lantanida, Sc dan Y.
KUMPULAN 17
Halogen merupakan satu siri kimia, dan merupakan unsur-unsur Kumpulan 17 (dulu Kumpulan VII) jadual berkala:
Fluorin (F), Klorin (Cl), Bromin (Br), Iodin (I), Astatin (At), Ununseptium (Uus) (belum dijumpai)
Istilah halogen bermaksud unsur yang menghasilkan garam bila bergabung dengan logam. Ia berasal dari tatanama saintifik Perancis pada abad ke-18.
Semua halogen wujud sebagai molekul-molekul dwiatom. Halogen lebih elektronegatif kerana mempunyai 7 elektrovalens - dua dalam subpetala s dan lima dalam subpetala p. Oleh kerana satu sahaja lagi elektron diperlukan untuk mencapai susunan oktet, maka halogen cenderung untuk menerima elektron dari unsur lain untuk memenuhkan petala elektron luarnya. Ini akan menghasilkan ion bercas negatif satu, dan dipanggil ion halida; garam yang mengandungi ion ini dipanggil halida. Namun, klorin mampu menunjukkan nombor pengoksidaan dari -1 sehingga +7. Halogen boleh membentuk ikatan kovalen mahupun ionik untuk mencapai susunan oktet.
Ion halida juga boleh bertindakbalas dengan atom hidrogen/air untuk menghasilkan asid. Contoh tindakbalas ialah klorin bertindakbalas dengan air menghasilkan asid hidroklorik dan asid hipoklorus (agen peluntur)
KUMPULAN 18
Gas adi atau gas nadir merujuk kepada gas dalam Kumpulan 18 Jadual berkala yang mempunyai sifat lengai, tidak reaktif, dan tidak bertindakbalas dengan bahan kimia lain. Gas nadir banyak digunakan dalam sektor perindustrian.
Ø Helium
Ø Neon
Ø Argon
Ø Kripton
Ø Xenon
Ø Radon
KESIMPULAN
Ø Kesimpulan yang dapat saya nyatakan di sini ialah kumpulan jadual berkala moden telah mula diperkenalkan oleh Moseley daripada jadual berkala Mendeleev. Alam ini di katakan terdiri daripada 109 unsur yang disusun dalam jadual berkala moden . turus yang menegak dalam jadual berkala dinamakan kumpulan sementara turus mengufuk dinamakan kala. Unsur-unsur disusun mengikut tertib nombor atom menaik dalam arah mengufuk.Jadual Berkala Moden mempunyai Kumpulan 1 hingga ke Kumpulan 18. Unsur-unsur dalam kumpulan yang sama akan mempunyai bilangan electron yang sama pada petala paling luar masing-masing. Jadual berkala mempunyai satu blok unsur-unsur yang berada di tengah-tengah jadual. Ia mengandungi unsur--unsur peralihan. Jadual ini mempunyai tujuh kala,iaitu dari kala 1 hingga ke kala 7.Electron-electron sesuatu unsur berputar-putar mengelilingi nukleus. Lintasan putaran ini dinamakan orbit dan disusun mengikut petala-petala. Konfigurasi electron ialah susunan electron disekeliling nukleus. Electron yang terletak di petala yang paling luar dinamakan electron valaens. Semua gas adi mempunyai ketumpatan yang sangat rendah. Semua gas adi mempunyai takat lebur dan takat didih rendah,tidak larut di dalam air dan tidak mengkonduksikan elektrik. Gas adi seperti He, Ne, dan Ar mempunyai banyak kepentingan dalam kehidupan seharian.
LAMPIRAN JADUAL BERKALA